教程来自李程教授课题组的seminar视频。地址:http://3d-genome.life/?page_id=149 讲的很清楚,强烈推荐实验方法原理不清晰的小伙伴们观看。
三维基因组实验原理
基于NGS的染色质三维构象捕获技术
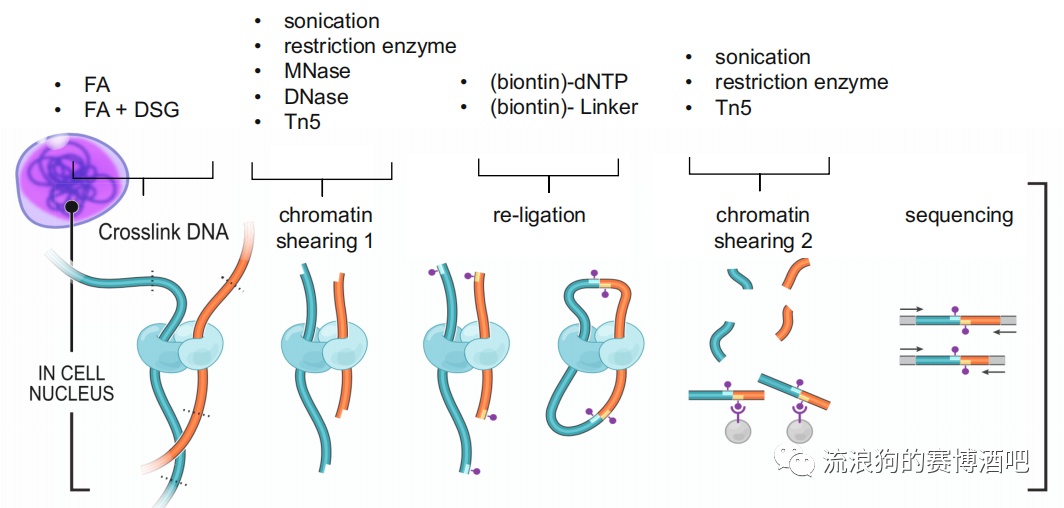
1. crosslink DNA
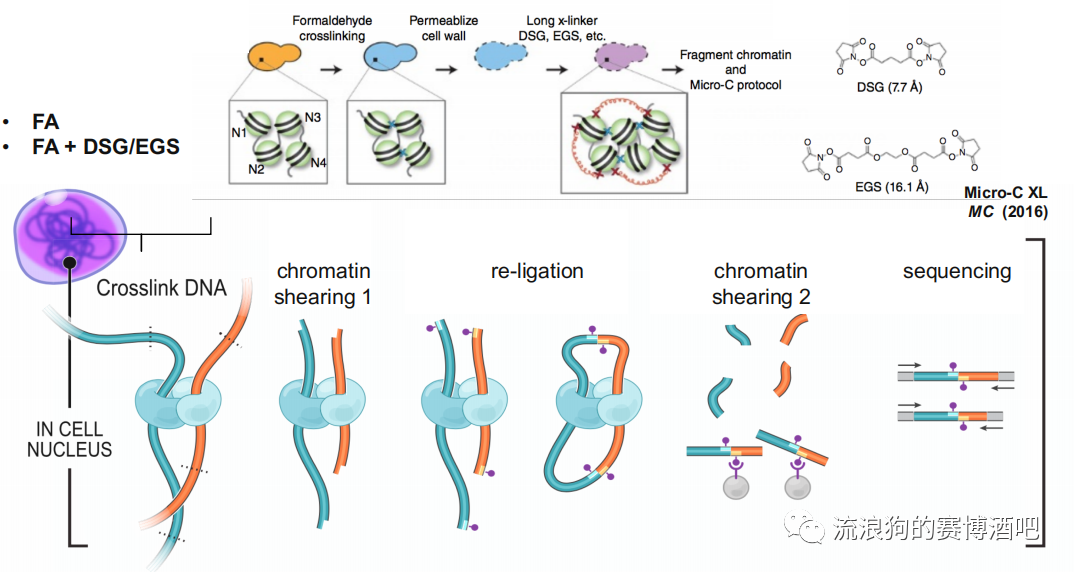 甲醛(FA)是小分子交联剂,只能交联距离极近的组蛋白,所以优点是背景干净,缺点是只能保留两两互作的交联关系,而complex结构无法保留。
甲醛(FA)是小分子交联剂,只能交联距离极近的组蛋白,所以优点是背景干净,缺点是只能保留两两互作的交联关系,而complex结构无法保留。
长交联剂(DSG/EGS)具有空间位阻,用于保留染色体之间或较远距离的互作关系。
2. 染色质打断chromatin shearing
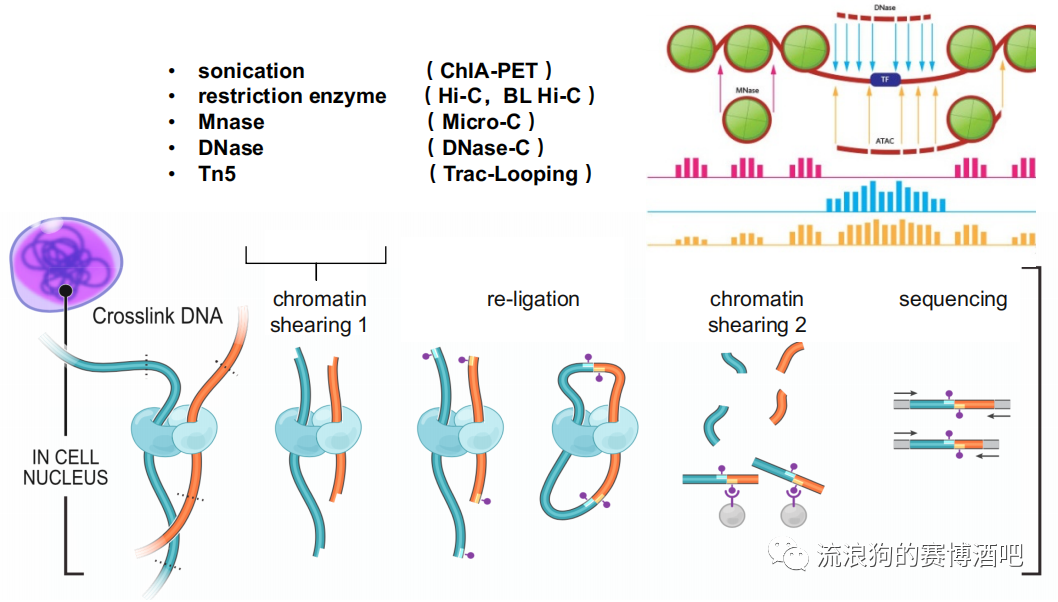
超声打断:
对染色质捕获没有序列偏好性,但效率很低且不均匀。
限制性内切酶:
Hi-C最常用。BL Hi-C选择性切割GC密集的区间,也就是主要捕获活跃调控元件之间的互作。
核酸裂解酶:
三种酶对染色质有不同的偏好性。
MNase 在浓度较低的情况下优先切割核小体之间的linker。由于它很擅长找linker,甚至最高分辨率可以把每个核小体都切开。所以如果测序深度高的情况下需要高精度数据的话(例如研究核小体结构水平的互作),Micro-C比Hi-C更加值得推荐。
DNase 更倾向于切割没有核小体的裸露开放染色质中没有被转录因子蛋白占位的地方,DNase的特点是可以把染色质切得非常碎(60bp)。
Tn5 相当于前两者的结合。所以ATAC的信号是最全的。并且,Tn5精度比较高。同时track-loop(Tn5)在切割后的连接步骤里表现很好。与之相反,DNase则由于切得太碎,存在连接不上的情况。所以更加推荐用Tn5。
重连接 re-ligation
re-ligation与第一次打断一样,都是重要环节,它的成环效率直接影响了能否观察到最终结果。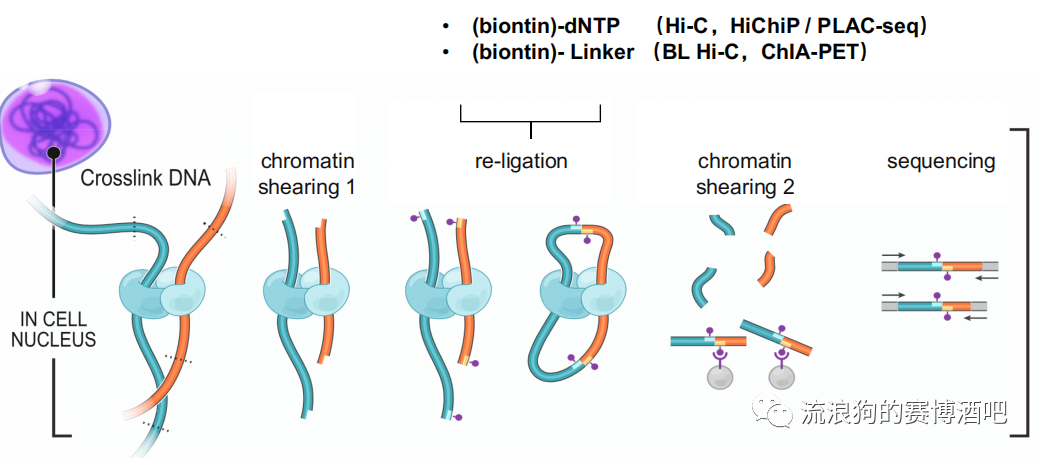
biotin-dNTP
与超声打断类似,属于没有长度的连接,引入单个碱基去连接。缺点是如果离得太远会连不上。
biotin-Linker 比较长,连接起来更容易。例如DNase把蛋白左右的染色质切得太碎,用dNTP够不到就很难连上,这时候可以选择使用长一点的Linker进行连接。如下图为BAT HiC的流程图,除了重连接使用的为Linker以外,其他步骤与HiC相同。这样就能提高loop的出现概率。 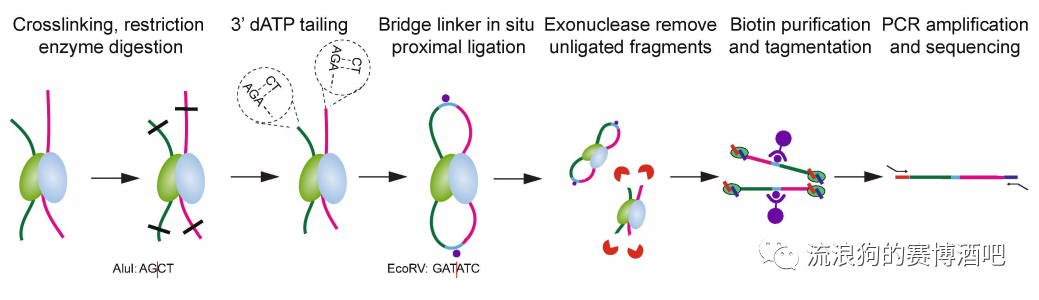
二次打断
由于loop的长度在10m左右,而测序无法测那么长。所以需要进一步打断成300-500bp的片段。
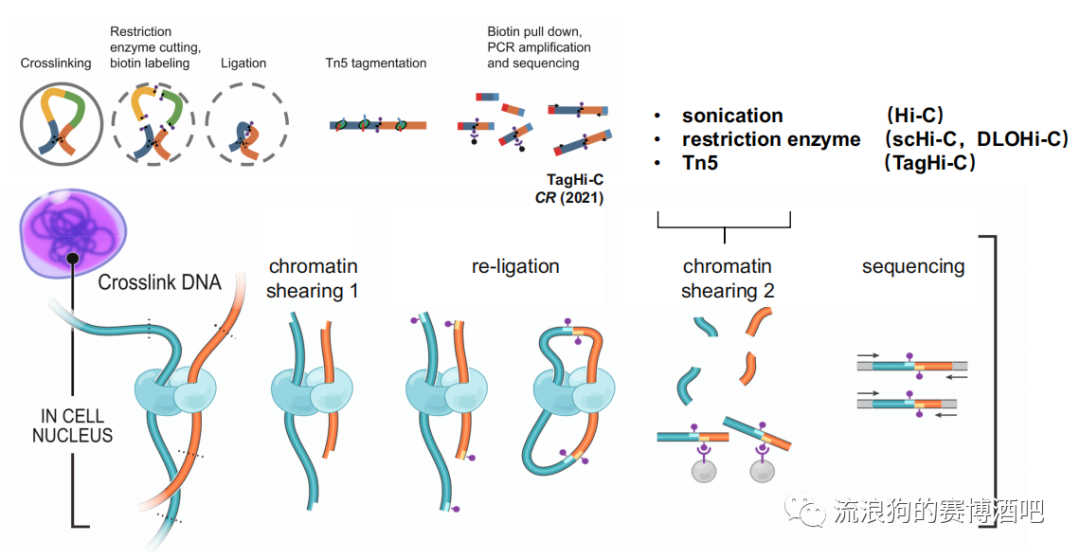
超声:90%的组学都会做超声。缺点是打断没有偏好性。
限制性内切酶:
以DLO HiC为例。普通的biotin用磁珠富集,后续操作都是带着磁珠的。而磁珠存在密度大、位阻大的问题,会给后续分析造成影响。而用特殊的限制性内切酶可以识别重组位点,并在上下游几十abp的位置进行切割,这样其他没有重组位点的大片段不会被切割。又因为在pcr扩增时大片段不能被扩增,所以自然富集了有重组位点的片段。但是这个方法的缺点是酶切操作复杂,成功率不高,所以用的不多。
而scHi-C使用这个方法则是因为传统的超声破碎技术需要较多的loop存在,因为在超声过程中的染色质损失非常大。用酶的话就可以把酶加到饱和,增加打断率。
Tn5:
取代超声增加片段均一化效率。并且Tn5打断后直接带着adapter。普通超声破碎后在建库前还需要加adapter,而这一步的效率也并不算特别高,所以也依赖于较高的DNA浓度。Tn5一步到位,效率高且损失小,适合微量细胞。缺点与内切酶一样,条件需要慢慢摸索。
QA:必须在活细胞或新鲜情况下交联,否则会损失构象。(不能使用冷冻的细胞,可以交联固定以后再冷冻) 大部分流程要求细胞浓度在10^6才能做出结果。